中肽生化助力提升我国临床研究质量管理
“源”远流长,医“药”同行,助力临床,质量先行

5月24日,第三届中国临床研究质量管理(GCP)暨ICH大会在下沙科技城圆满召开。本次大会由中国医药创新促进会、中国心血管健康联盟、中国抗血栓药物治疗联盟、杭州市投资促进局、杭州经济技术开发区管委会共同主办。中国医药创新促进会执行会长宋瑞霖、杭州市副市长陈新华、杭州经济技术开发区党工委书记、管委会主任邵立春出席会议并致辞。参加嘉宾主要来自药品审评机构、临床研究机构、药物基础研究机构等领域的众多专家,以及医药企业负责人。

会上,中肽生化有限公司总经理徐琪博士受邀发表了《全面质量管理在保障GCP科学研究中的实践》的主题演讲,并参加了分论坛一“ICH指南对临床科研的影响及GCP机构的发展方向”的研讨。
徐琪博士以临床试验“722”案例引出我国临床试验质量提升的迫切性和必要性,就如何加强申办方/CRO对临床试验的把控,如何提高临床医生的配合度,如何增强临床医生的GCP意识,如何提升CRC的服务质量等现实问题与参会嘉宾做了深度探讨,并分享了中肽生化子公司浙江源药医药有限公司的成功模式。
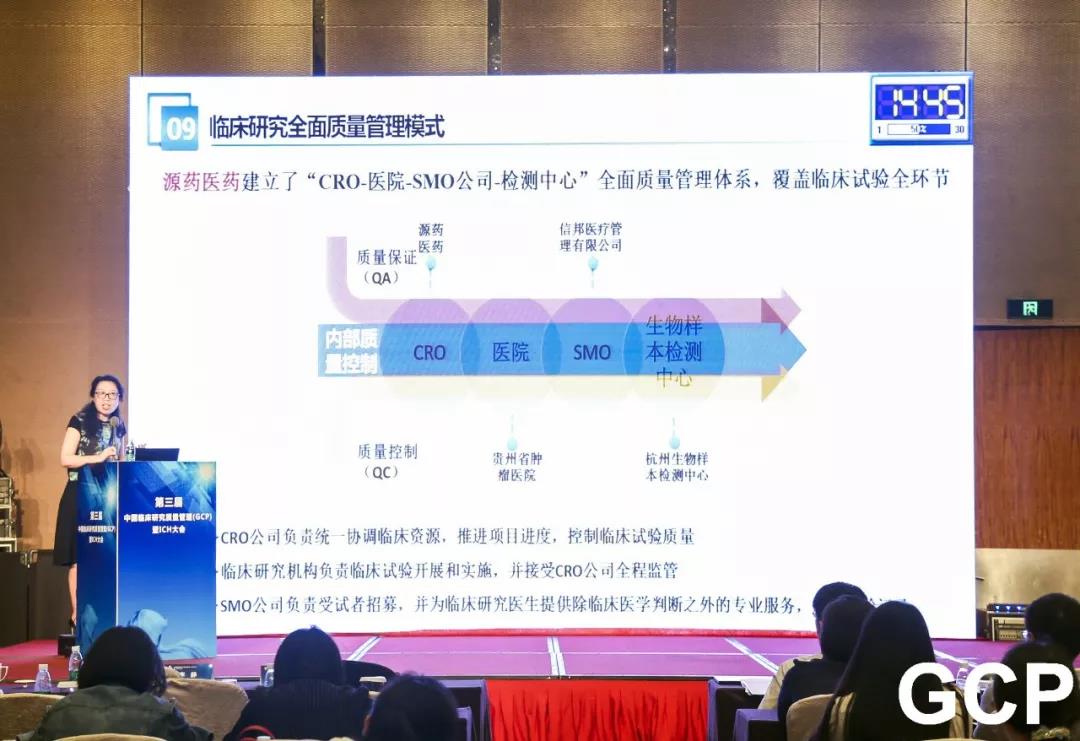
“全面质量管理”模式
近年来,我国医药政策改革力度和深度前所未有,超越了过去数十年的进展。随着CFDA正式加入ICH(国际人用药品技术要求协调会),意味着中国药品注册技术要求与国际接轨之路已经全面打开,药品研发和注册已经进入全球化时代,这对我们临床试验水平提出了更高的要求。源药公司根据临床试验国际标准的要求,建立符合国际GCP标准的临床试验管理与监督体系,实现了从“CRO-医院-SMO公司-检测中心”的全面质量管理体系,覆盖临床试验全产业链,全面高效推进临床试验进度,并有效保障临床试验质量与经济成本。
“三方互补”的质量体系
源药医药牵头建立多方互评考核机制,形成多联互动,通过CRC反馈,对医生进行考评,实行末位淘汰制,建立合格研究者库,调动研究者研究积极性,机构质控与企业CRA双向质控,确保质量体系有序运转,通过多重质控,确保临床试验质量。源药医药通过主动参与多方合作,从医院内部提升医生积极性和配合性,让专业的人做专业的事,积极接受CRO质量监督,不断提升临床试验质量。
先进质量管理成就了丰硕的研究成果
源药医药“全面质量管理” 模式运行8个月以来,先后开展40多项I-Ⅳ期的临床试验,完成临床试验11项,申办方稽查无重大不合格项,实现了临床试验的高质量、快速推进。

源药公司成立背景
2016年,中肽生化与信邦制药(证券代码:002390)完成资产重组后,高效整合了集团内创新技术研究、国际化质量管理体系、优质医院资源(信邦集团拥有8家医院,其中包括三甲医院——贵州省肿瘤医院,也是国内优秀的肿瘤专科医院),新设子公司浙江源药医药科技有限公司,开展全产业链药物临床研究工作。
源药公司发展宗旨
浙江源药医药科技有限公司致力于快速提高我国医药研发和临床研究水平与国际接轨,推动ICH相关指导原则在中国的转化实施,营造国际临床多区域试验良好环境,以更好地推动我国药物临床试验的科学、规范开展,促进临床研究机构与医药行业创新与国际竞争力的整体提升,让患者更快、更好地用上创新药!



