
厦门大学夏宁邵团队提出了一种新型的嵌合多肽生物大分子入胞递送系统,并将其成功用于小鼠急性肝损伤体内治疗模型中。
该研究不仅为生物大分子的胞内递送提供新的策略,而且为针对胞内靶标的蛋白药物的基础研究和临床应用奠定基础。
疾病的发生发展通常与细胞内信号网络异常相关,利用药物靶向调节相应的关键分子或功能途径进行干预是基础研究和临床治疗的重要手段。 生物大分子药物对靶标没有任何限制,而且在特异性及药效上也独具优势,因此成为药物研发最具前景而又竞争激烈的领域之一,但是生物大分子难以自由透过细胞膜到胞内,也因此目前获批的生物大分子药物所针对的靶标主要位于胞外或胞膜上。然而,绝大部分的(70%)的药物潜在靶标是位于细胞内部的,因此,如何有效地将生物大分子递送到细胞内部成为发掘这片未知的药物宝库的当务之急。 细胞穿膜肽(Cell-penetrating peptides, CPPs),如TAT,可介导生物大分子入胞,并且具有生物相容性高、操作简便、毒副作用低等优点,是目前蛋白质递送领域的研究热点之一。 该研究团队在TAT的基础上,同时引入pH敏感肽、内吞小泡特异性蛋白酶酶切位点以及多聚化结构域,克服了上述CPPs在应用中的技术瓶颈,构建成嵌合多肽递送系统eTAT(enhanced TAT)(图1d)。利用内吞小泡内蛋白酶对系统中酶切位点的切割作用,促使货物分子与递送系统分离进而实现有效的内吞小泡逃逸(图1c);而多聚化结构域(如亮氨酸拉链)的加入,克服了血清对于递送效率的影响(图1e)。随后,该研究团队以细胞内介导细胞坏死途径的RIP3蛋白为药物靶标,将eTAT系统与功能性蛋白Ppm1b融合表达组成治疗性分子eTAT-Ppm1b,用于APAP(对乙酰氨基酚,泰诺®)引起急性肝损伤的治疗性研究。
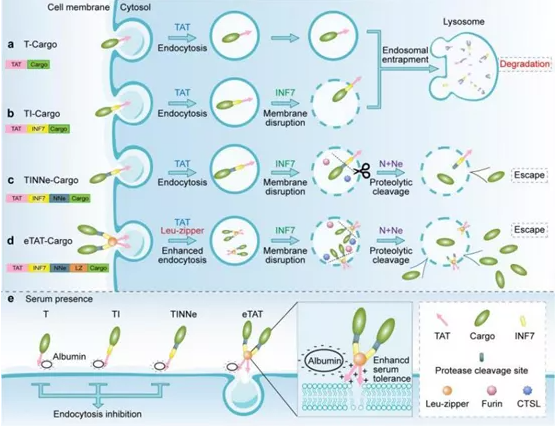
图1. eTAT与其它基于TAT 的递送系统的比较
引用来源:我院夏宁邵教授团队提出一种新型嵌合多肽生物大分子入胞递送系统 (xmu.edu.cn)




