
Francesca Curreli1, Sofia M B Victor1, Xiaohe Tong2, Christopher D. Hillyer3, Asim K Debnath1*
1 Laboratory of Molecular Modeling & Drug Design, Lindsley F. Kimball Research Institute, New York Blood Center, 310 E 67th Street, New York, NY 10065, USA
2 CPC Scientific, Inc., 160 E Tasman Dr. Suite 200, San Jose, CA 95134, USA
3 Lindsley F. Kimball Research Institute, New York Blood Center, 310 E 67th Street, New York, NY 10065, USA
摘要
人血管紧张素转换酶2 (ACE2)是SARS-CoV-2进入宿主细胞并启动感染过程的主要受体,因此,基于ACE2的关键结合位点进行药物分子的设计是非常明智的,该位点为约30个氨基酸残基组成的螺旋结构,中间还包含一个扭结。小肽在溶液中极易失去其螺旋构象,而依靠螺旋构象与SARS-CoV-2 RBD结合的能力也就随之失去。本文报道了基于该螺旋结构设计的四种钉书肽,后者有望与SARS-CoV-2有较高的亲和作用力,从而抑制病毒与ACE2受体结合,最终中断感染过程。所有的钉书肽均有较高的螺旋含量(50-94%的螺旋度),而作为对照的线性肽NYBSP-C几乎无螺旋度(19%)。本文还利用基于假病毒单周期感染试验,评价了这四条订书肽在HT1080和人肺细胞A549中的抗病毒活性,其中有三条在HT1080细胞系(IC50: 1.9~4.1)和A549系细胞(IC50: 2.2~2.8)中均有较好的抗病毒活性。值得注意的是,螺旋度最小的钉书肽NYBSP-3在上述两种细胞系中抗病毒活性也最低。最近报道的线性肽NYBSP-C和SBP1与SARS-CoV-2的KD值为~47nM,无抗病毒活性。最重要是,上述钉书肽即使在测试的最高剂量下,均无明显的细胞毒性。本文还测定了活性最高订书肽之一NYBSP-4的酶解稳定性,其在人血浆中的半衰期(T1/2)大于289 min。
引言
2019年,一种新型高致病性冠状病毒SARS-CoV-2在中国武汉首次被发现,该病毒引发的新型冠状病毒肺炎(COVID-19)在全球迅速蔓延,对公众健康和世界经济构成了重大威胁。2020年3月11日,世界卫生组织宣布COVID-19疫情为全球大流行病。截至2020年8月25日,213个国家受到了这一疾病的影响(https://www.worldometers.info/coronavirus/countries-where-coronavirus-spread/),有2300多万阳性病例,其中死亡81.3万人。在美国,确诊病例超过570万,死亡人数超过17.7万人(https://coronavirus.jhu.edu/data)。目前,尚无预防或治疗COVID-19的疫苗或药物,虽然瑞德西韦和诸如地塞米松等皮质类固醇,正在为COVID-19患者的治疗提供些许帮助。数个疫苗和其他用于治疗的药物也处于临床试验中。与其前身SARS-CoV一样,SARS-CoV-2通过与人类宿主受体血管紧张素转换酶2(ACE2)结合,利用刺突蛋白(spike protein,S蛋白)S1亚基上受体结合域(RBD)启动细胞进入。最近,可溶性人血管紧张素转换酶(hACE2)被提出作为竞争性的SARS-CoV阻断剂[1],重组人源性ACE2人源性ACE2 (rhACE2)正在进行临床试验[2]。然而,最近文献报道指出,无论是在人体还是小鼠体内,rACE2具有极快的清除率,经药代动力学研究得到的半衰期仅为几小时[3-4]。最近的研究结果表明,与人免疫球蛋白IgG1的Fc区融合,得到的人ACE2胞外域重组蛋白(ACE2-Ig),与SARS-CoV和SARS-CoV-2的RBD均具有高亲和力结合。ACE2-Ig也显示出有效的中和SARS-CoV-2,改善小鼠的药理特性[5]。尽管重组ACE2具有潜力,但在全球大流行的严峻形势下,重组蛋白因其治疗成本过高和稳定性太差实用性不高,尤其是在众多发展中国家。因此,我们试图设计更稳定、更廉价的治疗方案,使其能够更广泛推广。近期,Zhang等人报道了一种来自ACE2中α1螺旋序列的23肽(SBP1),它与SARS-CoV-2 RBD具有极强结合亲和力(KD=47nM),但尚无抗病毒活性的数据公开[6]。我们预测该线性短肽易于被蛋白酶水解,最重要的是,可能没有能够与SARS-CoV-2 RBD有效结合所需合适的二级结构。
最近报道的SARS-CoV2受体结合域(RBD)与全长ACE2的冷冻电镜和X射线晶体结构,揭示了这两种蛋白质结合时的结构细节[7-10]。进一步研究发现该相互作用表面长且平坦,这就不利于设计小分子药物来阻止蛋白质-蛋白质的相互作用。然而,有趣的是,该结构也揭示了一个长α螺旋(这里称为螺旋-1)与RBD的相互作用包含了多个结合“热点”。我们设计了基于ACE2受体螺旋(我们称为螺旋-1)与SARS-CoV-2 RBD结合的钉书肽。这些钉书肽有望与SARS-CoV-2的RBD具有高度亲和力,能够阻止SARS-CoV-2与宿主受体ACE2结合(Figure 1),从而阻止病毒进入宿主细胞。把SARS-CoV-2的进入途径作为药物靶点是预防和治疗新冠肺炎的理想选择,因为这从起点上阻止了病毒的生命周期。
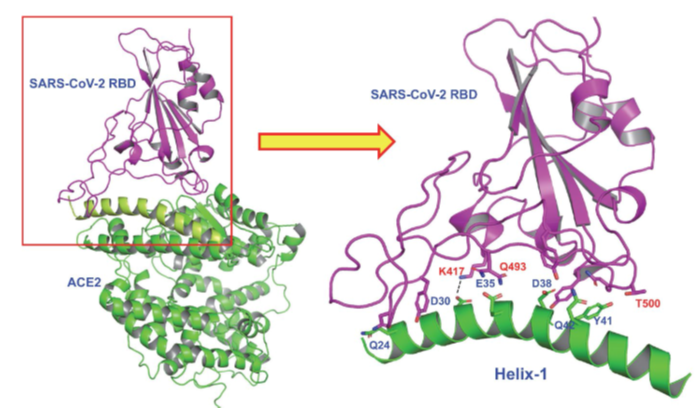
Figure 1 X-ray structure showing binding of SARS-CoV-2 RBD (violet) with ACE2 receptor (green). The detailed interactions of Helix-1 of ACE2 with SARS-CoV-2 RBD are indicated in the figure on the right.
宿主与病毒之间的蛋白质相互作用(PPI)是抑制病毒复制的重要靶点。然而,PPI中大而平坦的相互作用表面阻碍了小分子作为抑制PPI的药物。诸如多肽类似物(例如烃链订书拟肽)等分子量更大的生物分子,则有望成为PPI抑制剂解决上述棘手问题[11-14]。钉书肽通常衍生自结合界面处的α-螺旋结构,它们通过化学连接被锁定成具有生物活性的构象。钉合增强了无高级结构的短肽在溶液中的α-螺旋性,提高对酶解作用的耐受性和活性,还能提高细胞穿透性[15-21]。其中一个代号为ALRN-6924的钉书肽已进入各类适应症的临床试验,如淋巴瘤(1b/2期)、外周t细胞淋巴瘤(2a期)、急性髓系淋巴瘤(AML,1期)和晚期骨髓增生异常综合征(MDS, 1期)[22]。
本文中,我们利用ACE2的螺旋-1设计了多肽药物分子,用于治疗新冠肺炎。然而,螺旋-1很可能会在溶液中失去其螺旋构象;也就随之会失去大部分结合位点残基的定向作用,也就无法与结合位点处氨基酸残基产生合适的相互作用。为了解决这一问题,我们采用了上面提到的成熟的烃链钉合技术概念,增强螺旋-1的生物活性螺旋构象(Figure 2)。我们假设钉合后的肽呈现α-螺旋结构且可耐受蛋白酶水解,它们有望成为SARS-CoV-2的高亲和力结合物和强效抑制剂。
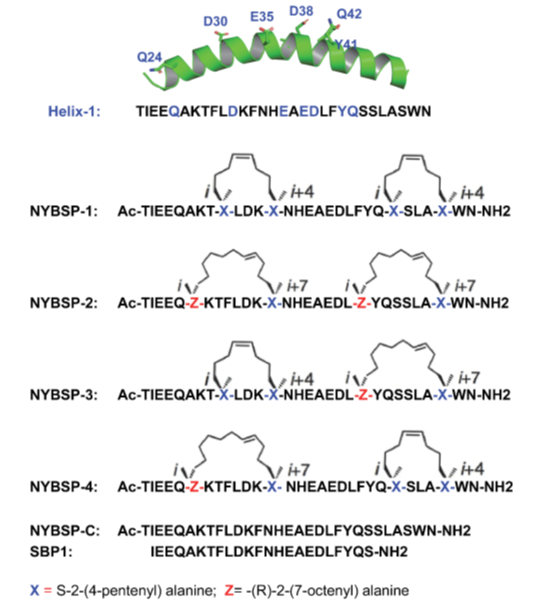
Figure 2. Double stapled peptides designed as anti-SARS-CoV-2 inhibitors. NYBSP-C and SBP16 were used as linear control peptides.
在本文中,报道了四种基于ACE2序列中螺旋-1的钉书肽的设计。在假病毒体外侵染试验中,其中3条肽具有较高的SARS-CoV-2抑制活性。上述订书肽伪装成ACE2中与SARS-CoV-2之间的结合位点,阻止了病毒与真正ACE2受体的结合,从而阻断病毒的侵入和感染,因此这些钉书肽是治疗COVID-19潜在药物分子。
结果与讨论
双订书肽的设计
最近利用冷冻电镜和x射线晶体衍射解析的结构提供了有关SARS-CoV-2 RBD如何与宿主受体ACE2结合的复杂细节,其主要结合位点位于ACE2的螺旋-1上(Figure 1)。最近有文献[23]报道,依照ACE2螺旋-1结构经计算机设计的短肽,与SARS-CoV-2 RBD具备了纳摩尔级别的结合亲和力。但该线性肽单独作为药物,其实用性尚未得到证实。一般而言,当蛋白质分子中的一段螺旋作为肽段截取后,其二级结构也就随之失去。截取出来的肽段也更易于被蛋白酶水解。而如果这些小的肽段被烃类“订书钉”约束后,其螺旋度和抗蛋白酶水解的能力随之提高,同时结合亲和力和生物活性也得到加强[11-21, 24-25]。因此,我们设想将该螺旋-1的钉合,使其α-螺旋二级结构稳定且不被蛋白酶水解,最终成为一个SARS-CoV-2高效抑制剂。
i, Ii+4和i, i+7烃链钉合
我们利用成熟的钉合技术,依照ACE2中螺旋-1的序列,合成了相应的烃链钉合肽[26-28]。这些订书肽将维持高的α-螺旋度,与SARS-CoV-2 RBD有较高的结合亲和力,同时抗病毒活性及酶解稳定性也得到提高。与SARS-CoV-2 RBD结合的螺旋序列相对较长,因此采用了双重钉合。已有文献[20, 29-30]报道,双钉法可使订书肽产生显著的抗蛋白酶水解特性。此外,Mourtada等[24]最近报道双订书肽比单订书肽的抗病毒效力提高了2-4倍。据报道[29],双订合还能改善药代动力学,包括多肽类HIV-1融合抑制剂的口服吸收过程。为了实现i、i+4和i、i+7四个位点的订合,采用了非天然氨基酸(如Figure2所示)将烃链“订书钉”引入至螺旋-1序列中。依据前述冷冻电镜和X射线晶体衍射获得的SARS-CoV-2 RBD与ACE2的结合位点信息,合理选取了订合位点,因此后者不会干扰关键结合位点的氨基酸残基。我们(CPC Scientific, Inc.)合成了4个钉书肽,如Figure 2所示,同时还合成了线性肽NYBSP-C作为对照。此外,还外购了线性肽SBP1作为对照,有最近的文献[6]报道该肽能够以高亲和力(KD = 47nM)与SARS-CoV-2 RBD结合。
双订合对螺旋倾向的影响
由于螺旋-1的增大,我们决定将ACE2中螺旋-1进行双订合,以保留肽的α-螺旋含量。为了测定这些多肽的螺旋倾向,我们借助CD光谱来分析其二级结构。Figure3(A)中的数据表明,所有的钉书肽在190 nm处有最大值,在208和222 nm处有两个最小值,证实所有钉书肽均具有螺旋结构。相对于线性肽,螺旋度含量显著提高。Figure3(B)中的数据显示,NYBSP-1的螺旋倾向性最高,为94%。钉书肽NYBSP-2和NYBSP-4的螺旋度含量分别为61%和80%。其中NYBSP-3的螺旋度含量最低(50%)。正如预期,对照肽NYBSP-C无α-螺旋倾向,仅有19%的螺旋度。
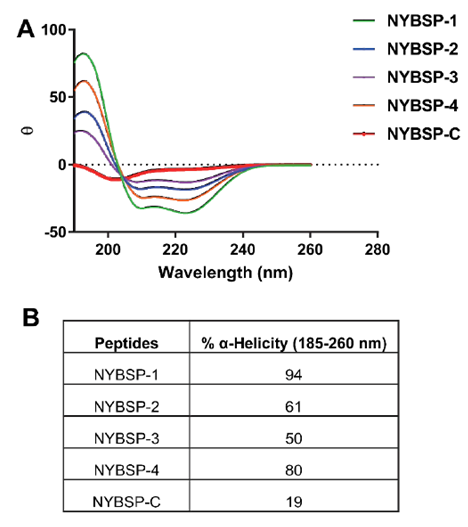
Figure 3. α-Helical propensity measured by CD spectroscopy (A) CD spectra, (B) % Helicity of stapled peptides, and the linear control peptide.
人血浆中钉书肽的酶解稳定性研究
酶解稳定性依然是多肽药物开发中的一个潜在问题。我们想通过在ACE2受体的螺旋-1中引入双钉合来解决这个问题。众所周知,双钉合可以加强对肽段的保护,使其免受蛋白酶水解。但是,为了慎重起见,我们测试了我们设计的这些订书肽在人血浆中抵抗蛋白酶水解的能力。将肽段与人血浆在37˚C恒温反应,在不同时间点(0、10、30、60、120 min),用LC-MS/MS测定酶解形成的片段。我们使用了一种小分子药物,溴丙胺太林作为含量测定对照。Figure 4中的数据显示,钉书肽NYBSP-4在检测时间内高度稳定。NYBSP-4计算的半衰期(T1/2)为>289 min,但令人意外的是,线性对照肽NYBSP-C也表现出类似的稳定性(T1/2 >289 min)。按照常识,小肽会很快被蛋白酶水解。在本实验中,线性肽在人血浆中不寻常的稳定性,其原因尚不清楚。
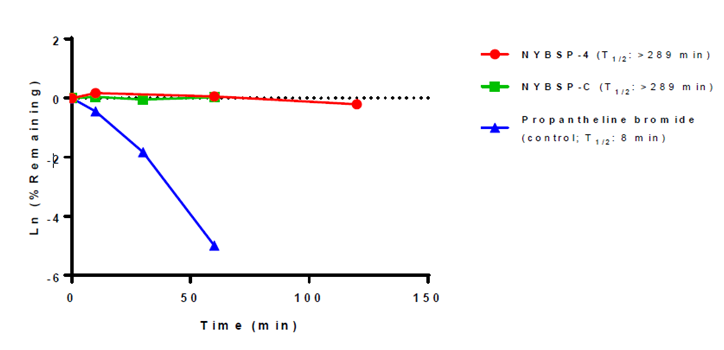
Figure 4. The plasm stability of stapled peptide NYBSP-4 (red) and control linear peptide, NYBSP-C (green). Propantheline bromide (a small molecule antimuscarinic agent) was used as an assay control.
SARS-CoV-2假病毒的验证
我们用HIV-1env缺失的前病毒主链质粒pNL4-3ΔEnv-NanoLuc和pSARS-CoV-2-Strunc质粒转染HEK293T/17细胞,制备了具有单周期感染能力的SARS-CoV-2假病毒。通过使用SARS Spike蛋白抗体(Novus Biologicals)的Western 印迹分析验证了spike蛋白在假病毒中的结合(Figure 5)。该抗体明确靶向刺突蛋白S2的1124-1140氨基酸。我们在先前报道[31-32]的第二个蛋白中发现了一个KDS2亚单位,它与SARS病毒的第二个结合带一致。
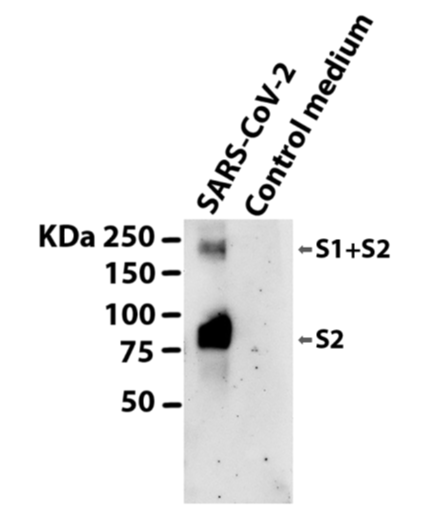
双钉书肽的抗SARS-CoV-2活性及细胞毒性研究
我们用SARS-CoV-2假病毒感染人纤维肉瘤(HT1080/ACE2)细胞和表达人血管紧张素转换酶2(A549/ACE2细胞)的人肺癌细胞,评价了双订书肽的抗SARS-CoV-2活性。以麻省理工学院最近报道的一组线性肽NYBSP-C和23个氨基酸的人ACE2受体衍生线性肽SBP16作为对照[6],计算了抑制SARS-cov2假病毒感染50%(IC50)所需的浓度。结果见Table 1。剂量-反应图(Figure 6)表明,所有的双钉书肽都能有效地抑制SARS-CoV-2对HT1080/ACE2细胞和A549/ACE2细胞的感染。四条订书肽中的三条,在两种细胞系中都显示出强大的抗病毒活性。NYBSP-1在HT1080/ACE2和A549/ACE2细胞中的IC50分别为4.1±0.26和2.2±0.14,NYBSP-2的IC50分别为2.9±0.27和2.68±0.14,NYBSP-4的IC50分别为1.97±0.14和2.8±0.08。在HT1080/ACE细胞中NYBSP-3活性最低,IC50为12.9±0.35μM,A549/ACE2细胞为25 μM。最显著的是,两个对照线性肽NYBSP-C和SBP1均未显示出任何抗病毒活性。值得注意的是,NYBSP-3的α-螺旋度最低,其抗病毒活性也最低。
Table 1. Antiviral activity (IC50) of peptides in single cycle assay in HT1080/ACE2 and A549/ACE2 cells infected with pseudovirus NL4-3ΔEnv-NanoLuc/SARS-CoV-2) and cytotoxicity (CC50).
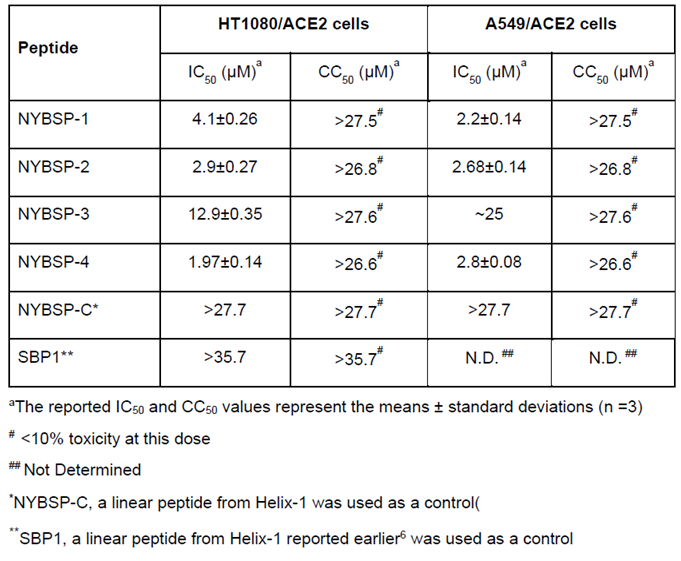
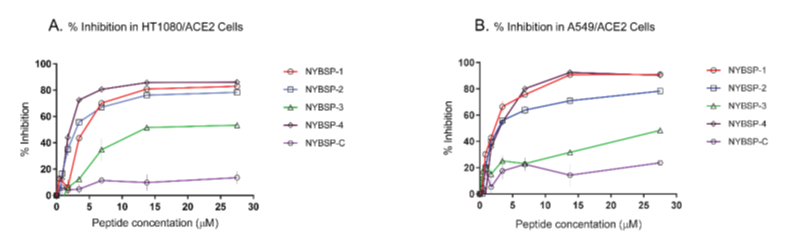
Figure 6. Dose-Response plots of the antiviral activity of peptides in a single-cycle assay performed in HT1080/ACE2 and A549/ACE2 cells infected with pseudovirus NL4-3ΔEnv-NanoLuc/SARS-CoV-2. Antiviral activity in (A) HT1080/ACE2 cells and (B) A549/ACE2 cells. Data on stapled peptides NYBSP-1, NYBSP-2, NYBSP-3, NYBSP-4, and a control Linear peptide NYBSP-C are shown as mean ± SD of three independent experiments.
与抑制试验同时评估肽的细胞毒性(CC50)。我们发现,在最高测试剂量下,该肽不会诱导任何明显的细胞毒性。在本试验中使用的较高剂量下检测到<10%的毒性(Table 1和Figure 6)。
方法
多肽合成:偶联反应的通用操作
将Fmoc Rink Amide MBHA树脂(0.1 mmol)在DMF(20 mL)中溶胀1h,过滤悬浮液。向树脂中添加20%哌啶(DMF)(20 mL)脱除Fmoc。将悬浮液在室温下氮气鼓泡0.5h。过滤混合物,将树脂用DMF(6x20 mL)洗涤。将Fmoc-Asn(Trt)-OH(0.3 mmol)和DIC(0.3 mmol)、HOBt(0.3 mmol)在10 mL DMF中预活化,然后将混合物加入树脂中。反应在氮气保护下进行,茚三酮试验用于判别反应是否完全。待反应完全,过滤悬浮液,树脂用DMF(3x20 mL)洗涤。之后完成序列中所有氨基酸的偶联,得到全保护的肽树脂,再用Grubbs 1代催化剂进行环化反应。
用DCM(3x20mL)洗涤肽树脂后,在反应瓶中加入10ml 1,2-二氯乙烷,氮气鼓泡15 min,加入30 mg Grubbs 1代催化剂,氮气鼓泡4h,过滤,树脂用MeOH(2x150 mL)、DCM(2x150 mL)和MeOH(2x150 mL)依次洗涤。将树脂过夜真空干燥,得到环化的肽树脂。
将E溶液(TFA:硫代苯甲醚:苯酚:乙二硫醇:水=87.5:5:2.5:2.5, 350 mL)加入到肽树脂中,振摇3.5 h,过滤。将乙醚(2000 mL)加入滤液中,沉淀出肽。将混合物离心,弃去乙醚层。所得固体用乙醚洗涤三次,过夜真空干燥,得到粗品。
粗肽经制备色谱纯化至>90%的纯度。所有肽段均在C端乙酰化和N端酰胺化。所有肽的分子量通过电喷雾质谱测定。
圆二色谱分析
用于计算α-螺旋度的二级结构分析由Creative Biolabs(New York, NY, USA)完成。测定过程可简单描述为,将肽溶解于10mM PBS中,得到肽最终浓度为0.125mg/ml的PBS溶液。圆二色光谱是在Chirascan分光偏振计(Applied Photophysics, Leatherhead, UK)上测定。测量参数设置如下:波长185-260nm,步长0.5nm,温度25℃。使用软件CDNN(Circular Dichroism analysis using Neural Networks)计算螺旋度% (http://gerald-boehm.de/download/cdnn)[33]。
血浆稳定性研究
血浆稳定性研究由Creative-Biolabs (New York, NY, USA)完成。实验过程可简单描述为,实验前在37˚C的水浴中解冻冷冻的人体血浆(BioIVT, UK)。将血浆以4000 rpm离心5分钟,如果有血块,则将血块移除。如有必要,将pH值调整至7.4±0.1。用5%氨水和水配制1 mM的多肽储备液。用90μL超纯水稀释10μL储备液配制1 mM阳性对照溴丙胺太林中间溶液。
对照组:用90 μL 45% MeOH/H2O稀释10 μL中间溶液(1 mM)配制成100 μM给药溶液。对于测试肽,通过用90 μL DMSO稀释10 μL中间溶液(1 mM)配制成100 μM给药溶液。在98 μL空白血浆中2 μL给药溶液(100 μM),以达到2 μM的最终浓度,一式两份,样品37℃恒温水浴。在每个时间点(0、10、30、60和120min),先添加4%H3PO4 100 μL,再添加800 μL终止溶液(200 ng/mL甲苯磺丁脲和200 ng/mL拉贝洛尔的MeOH溶液)使蛋白质沉淀并充分混合。样品板以4000 rpm离心10 min。将100μL上清液从每个孔转移到平板上。在进行LC-MS/MS分析之前,将样品以800 rpm的速度振荡约10 min。测试肽段在血浆中恒温反应后的剩余百分比,用以下公式计算:
剩余%=100 x(指定恒温反应时间后的PAR /T0时间的PAR)
其中PAR是分析物与内标(IS)的峰面积比
细胞和病毒
HT1080/ACE2(人纤维肉瘤)细胞和两个编号为pNL4-3dEnv-NanoLuc和pSARS-CoV-2-Strunc的质粒由洛克菲勒大学(Rockefeller University)Paul Bieniasz博士赠送。从美国国立卫生研究院(NIH)国家过敏和传染病研究所(NIAID)所属的BEI-Resources处购得表达人血管紧张素转换酶2(HA-FLAG)的人肺癌细胞(A549)(目录号:NR-53522)。HEK293T/17细胞购自ATCC。
假病毒的制备与分析
为了制备能够单周期感染的假病毒,在10x106 HEK293T/17细胞中用FuGENE6(Promega)和pSARS-CoV-2-Strunc质粒转染10x106 HEK293T/17细胞。在感染两天后收集含有假病毒的上清液,过滤,滴定,并等分保存在−80°C下。另外,为了确认刺蛋白已进入假病毒中,将2 mL上清液在20%蔗糖缓冲液上以38000 rpm超离心2h,以浓缩病毒颗粒。对病毒颗粒进行裂解和处理以进行蛋白质分析。病毒蛋白在NuPAGE Novex 4–12% Bis-Tris凝胶(Invitrogen)上分解,并用SARS棘蛋白抗体进行免疫检测(目录号:NB100-56578;Novus Biological)。以抗兔IgG-HRP全抗体(GE-Healthcare)作为二级抗体。用化学发光法观察蛋白质。
抗病毒活性测定
HT1080/ACE2细胞。通过用SARS-CoV-2假病毒感染HT1080/ACE2细胞,在单周期感染试验中评价双钉书肽的抗病毒活性。实验过程可简单描述为,在96孔培养板中,将等分试样的SARS-CoV-2的样本与递增浓度的双钉书肽预培养30 min。然后将2x104个细胞添加到每孔中,并在37℃培养。培养24h后,将细胞用100 μL PBS溶液裂解液洗涤后,用50 μL裂解缓冲液(Promega)裂解。将25 μL细胞裂解液转移到白色平板上,与等体积的Nano-Glo®荧光素酶试剂(Promega)混合。随即用SPARK多功能酶标仪(Tecan, Research Triangle Park, NC)测定荧光素酶活性。使用GraphPad Prism 7.0软件(San Diego, CA)计算肽的抑制率和IC50(最大抑制浓度的一半)值。
A549 / ACE2细胞。为了评价A549 / ACE2细胞中的抗病毒活性,将假病毒SARS-CoV-2的等分样本与递增浓度的双钉书肽预培养30 min。然后,将1×104个细胞加入到每孔中培养。培养48 h后,将细胞用PBS洗涤并用50 μL裂解缓冲液裂解。如上所述处理25 μL细胞裂解液,以测量萤光素酶活性并计算肽和IC50值。
细胞毒性评价
HT1080 / ACE2细胞。HT1080/ACE2细胞中双钉书肽的细胞毒性评价与抗病毒活性测定同时进行,并根据制造商的说明使用比色CellTiter 96®单溶液细胞增殖试验(MTS) (Promega)进行测量。实验过程可简单描述为,将等分试样的100 μL肽以分级浓度与2x104/孔HT1080/ACE2细胞混合,并在37℃下培养。培养24 h后,将MTS试剂添加到细胞中,并在37ºC下培养4 h。在490nm处记录吸光度。如上计算细胞毒性的百分比和CC50(50%细胞毒性的浓度)值。
A549/ACE2细胞。在A549/ACE2细胞中进行细胞毒性试验时,将递增浓度的等份双订书肽与1x104/孔A549/ACE2细胞培养,并在37°C下培养。培养48 h后,将MTS试剂添加到细胞中,并在37°C下培养4h。在490 nm下记录吸光度。如上计算细胞毒性百分比和CC50值。
结论
鉴于当前疫情大流行的趋势,开发针对COVID-19的药物已迫在眉睫。我们利用了SARS-CoV-2 RBD和ACE2受体结合位点的结构信息。我们设想,通过模拟ACE2序列中的能够与SARS-CoV-2 RBD结合的螺旋片段,设计的订书肽可以作为诱骗受体,优先与SARS-CoV-2结合,阻止其进入宿主细胞,从而阻断病毒感染。我们成功设计了对HT1080/ACE2和人肺癌细胞A549/ACE2具有抗病毒活性的双订书肽。更重要的是,这三种对SARS-CoV-2假病毒具有强大活性订书肽,均有较高的螺旋含量(60-94%)。NYBSP-4是活性最强的订书肽之一,其在人血浆中的蛋白水解酶具有一定的耐受能力。该订书肽先导分子将为进一步结构优化直至找到临床候选分子铺平了道路。




