
本文报道了Ser炔丙基i,i+7位点通过1,3-二炔装订形成的α-螺旋具有很好的稳定性。
蛋白与蛋白之间的相互作用(PPIs)控制着最基本的细胞过程并且影响很多生物功能。然而,尽管这些最基本的角色,PPIs被认为是药物设计时非常复杂的目标,因为这些大的通常是平的接触面不易被小分子所识别。尽管如此,调节PPIs对阐明生物学特性很重要,并且被认为是下一代治疗方法非常有前景的策略。因此,设计PPIs抑制剂的方法通常是基于结构的方法,即蛋白质表位的拓扑结构作为一个起点。鉴于PPIs发生在大的相互作用表面积上,通常是750到1500 ,所以只有少量的关键残基有助于这种结合亲和力。而这些表位通常由潜在氨基酸链的二级结构所决定。具体来说,α-螺旋是许多天然PPIs的关键识别点。
因此模仿这种α-螺旋结构在过去十年受到广泛关注。然而,当α肽片段从蛋白中提取出来以后,通常会观察到一个经典的构象显著损失的现象。所以,这就需要二级结构足够稳定。
目前为止,已报道稳定α-螺旋结构比较成功的策略是在氨基酸侧链特殊位点引入共价键的链实现。结果表明,这些装订肽与它们对应的直链肽相比具有以下特点:高结合亲和力、代谢稳定性和强细胞渗透性。为了得到这些α-螺旋模拟物,通常涉及到在氨基酸侧链的i,i+4,i+7位点通过一个或两个螺旋桥来实现。然而,大量的工作是实现i,i+4的环化,而当前的报道聚焦在i,i+7的环化。
Schafmeister等人报道了含有烯烃关环复分解(RCM)的多肽。该装订链通过i,i+4实现,但该链对肽链α螺旋的稳定性没有什么影响。Fujimoto等人表明短肽的α螺旋可通过Lys残基在i,i+4,i+7位置酰基化反应的预处理进行稳定。圆二色谱表明,在i,i+4位置的装订能实现35%的α螺旋,而在i,i+7位置的装订可实现65%的α螺旋。
首例实现i,i+7螺旋肽的研究工作是通过两个D/L 2-氨基-6-巯基己酸之间的二硫键实现的(见图1A)。与对应的非环肽相比,该环肽有一个灵活的10原子链,增强了螺旋性。同样,双芳甲基溴代物也可通过i,i+7位点被用来连接两个Cys的侧链巯基,该环状类似物的螺旋性和生物活性都得到了提高。光可转化的偶氮苯也可被用作合成一种基于硫醇,含两个螺旋的交联物(见图1B)。当在i,i+7位置进行连接时,偶氮苯处于顺式时,α螺旋构型更加的明显。此外,Fujimoto等人成功研究了9个i,i+7装订肽,桥环包括短的烯烃,苯基,双苯基,并且插入这些元素的确可以增强一些类似物的螺旋性。增强螺旋性的方法也可以通过Glu双酰胺的交叉链和二胺化物在i,i+7位点进行连接(见图1C)。铜催化不同的叠氮和炔烃环化也可被成功应用于稳定α-螺旋(见图1D)。例如,双三氮唑侧链可以通过Lys叠氮在i,i+7位点与芳基二炔化物通过双Click反应获得。为了引入全碳氢装订链,Verdine等人研究了稳定α螺旋强有力的工具:引入α-甲基-α烯基氨基酸通过RCM反应引入装订肽(见图1E)。该11碳链可通过R和S构型的α-甲基-α烯基氨基酸进行合成,且i,i+7位点是形成螺环的最佳位点。
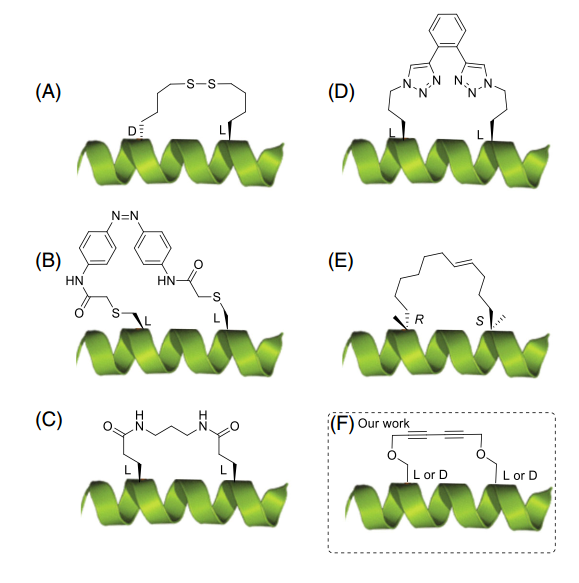
图 1
在最近几年,一些研究报道了使用1,3-二炔通过Glaser-Hay炔炔偶联的方法来稳定多肽的二级结构和生物正交标记。鉴于炔炔偶联在多肽化学中的持续兴趣,作者测试了使用炔丙基化的Ser在i,i+7位点来稳定两个螺环结构(见图1F)。
在该篇研究工作中,α-螺旋通过1,3-二炔在i,i+7位置的炔丙基Ser残基位点被成功稳定。但更重要的是,炔丙基Ser构型的不同对α-螺旋的影响通过圆二色谱,核磁和分子模型得到了充分的研究。
总之,本文在D型和L型Ser炔丙基i,i+7位点通过1,3-二炔装订形成的α-螺旋具有很好的稳定性。在目前的研究中,通过核磁和分子模型所做的系统结构分析证明[L-Ser4,L-Ser11]的组合仅能提供大环的一个螺环结构,然而外环片段并不是螺环的一部分。相比之下,[D-Ser4,L-Ser11]的组合对整个肽链来说,充分提供了一个完整的α-螺旋结构。类似关于装订肽的报道都聚焦在螺环肽,当使用不同构型的氨基酸时会有不同的差异性,而该研究的亮点就在于强调了在成环位点侧链朝向的重要性。该文章作者的研究不仅丰富了装订肽侧链的种类,而且详细研究了侧链不同构型氨基酸朝向对α螺旋的影响,为PPIs提供了稳定的识别点,对多肽药物的开发拓宽了思路。
来源:![]() 原文献.pdf
原文献.pdf




